O que é o Procedimento de Rashkind e por que ele é essencial para recém-nascidos?
Procedimento de Rashkind
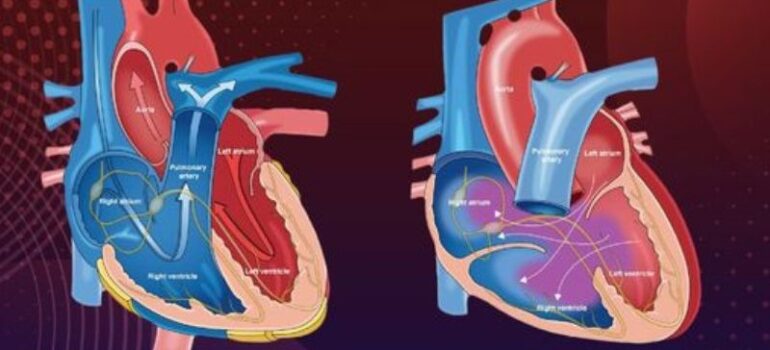
O Procedimento de Rashkind, também conhecido como atriosseptostomia por balão, é uma intervenção cardíaca paliativa e minimamente invasiva, realizada em recém-nascidos com cardiopatias congênitas críticas que dependem da mistura de sangue entre os átrios para sobreviver. Seu principal objetivo é ampliar a comunicação entre os átrios (criando ou aumentando uma comunicação interatrial), permitindo a mistura de sangue oxigenado e não oxigenado e, assim, melhorando a circulação e a oxigenação do organismo.
Esse procedimento é indicado principalmente para condições como:
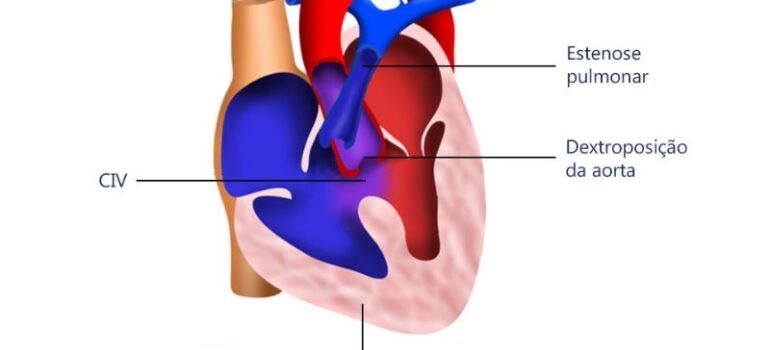
- Transposição das Grandes Artérias (TGA) com comunicação interatrial restritiva
- Drenagem Anômala Total de Veias Pulmonares (DATVP)
- Síndrome do Coração Esquerdo Hipoplásico (SCEH)
- Atresia Pulmonar
- Atresia Tricúspide
Como o procedimento é realizado?
Durante o procedimento, um cateter com um balão na ponta é inserido através de um vaso sanguíneo, geralmente na virilha, e guiado até o coração com o auxílio de imagens de raio-X (fluoroscopia). O cateter é cuidadosamente posicionado no átrio esquerdo, passando pelo forame oval — uma abertura natural entre os átrios presente em recém-nascidos.
Uma vez no local, o balão é inflado e, em seguida, puxado de volta para o átrio direito. Esse movimento, amplia a abertura do septo atrial ou cria uma nova comunicação entre os dois átrios. Essa abertura permite que o sangue rico em oxigênio (vindo dos pulmões) se misture com o sangue pobre em oxigênio (vindo do corpo), melhorando a oxigenação do sangue que circula pelo organismo.
O procedimento é rápido e minimamente invasivo, sendo realizado em poucos minutos. Ele é essencial para estabilizar recém-nascidos com cardiopatias críticas, até que uma cirurgia corretiva definitiva possa ser realizada.
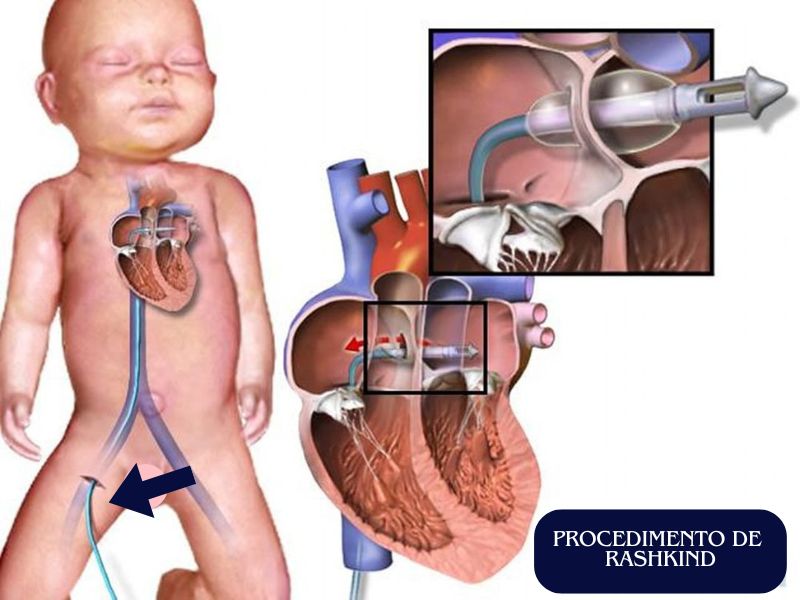
Procedimento de Rashkind
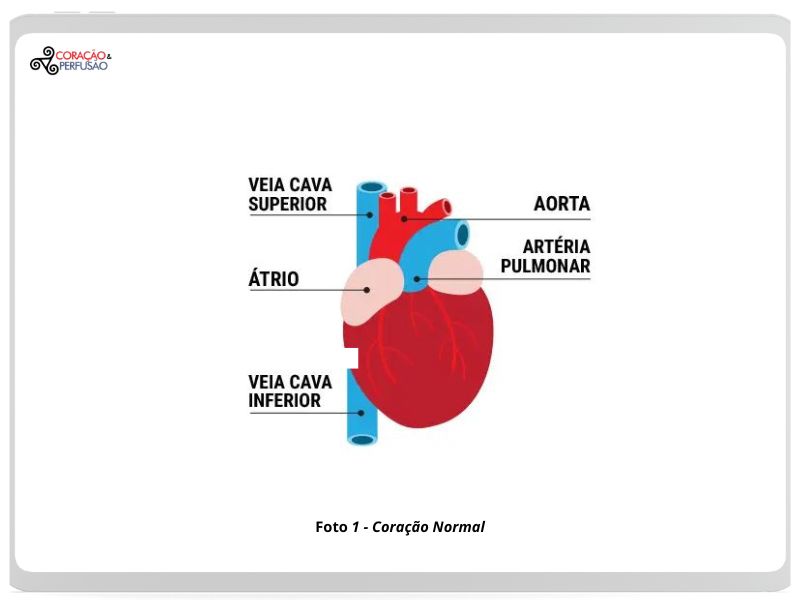
O que é o forame oval?
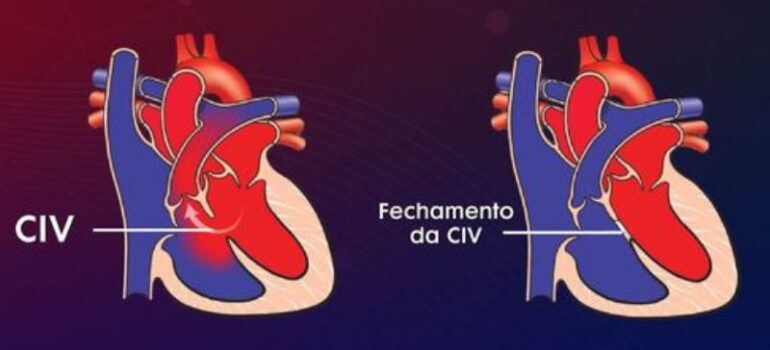
O forame oval é um pequeno orifício localizado no septo do feto. O septo é a parede entre os lados direito e esquerdo do coração. O forame oval serve como uma passagem para o sangue fluir do lado direito para o lado esquerdo do coração fetal
Por que o forame oval é importante em uma septostomia?
Graças ao forame oval, bebês que apresentam defeitos cardíacos cianóticos podem sobreviver por alguns dias após o nascimento. Essa pequena abertura natural entre os átrios permite que uma pequena quantidade de sangue rico em oxigênio se misture com o sangue pobre em oxigênio, mantendo a circulação e a oxigenação do corpo. No entanto, quando o forame oval se fecha naturalmente, essa passagem desaparece, e o bebê deixa de receber sangue oxigenado suficiente, colocando sua vida em risco. Nesses casos, é necessária uma intervenção imediata. Foi nesse contexto que a septostomia por balão, desenvolvida em 1966, se tornou um avanço médico revolucionário.
Em casos em que o forame oval já está fechado, a septostomia pode criar um orifício no septo interatrial, utilizando um cateter com lâmina especial. Embora a ideia de criar um orifício no coração possa parecer contraditória, essa intervenção é essencial para a sobrevivência de alguns bebês.
Pacientes com cardiopatias críticas
Em condições ideais, crianças diagnosticadas com cardiopatia crítica ainda no período fetal devem nascer em hospitais especializados e equipados para realizar o procedimento imediatamente após o nascimento, seguido pela cirurgia apropriada para cada caso. Embora não esteja isento de complicações, como arritmias ou lesões vasculares, o procedimento é altamente eficaz e pode salvar muitas vidas, proporcionando uma condição mais estável e segura para a cirurgia definitiva.
Como saber se o procedimento foi bem-sucedido?
Em geral, uma septostomia atrial é bem-sucedida se qualquer uma destas condições for atendida:
- A quantidade de oxigênio nas artérias do seu bebê aumenta em 10%.
- O orifício no septo está pelo menos 33% mais largo do que era antes do procedimento.
- Há uma diferença mínima na pressão arterial entre os átrios direito e esquerdo.
Importância do procedimento na medicina
O procedimento de Rashkind revolucionou o tratamento de cardiopatias congênitas críticas, como a transposição das grandes artérias e a síndrome do coração esquerdo hipoplásico. Ele permitiu que recém-nascidos com condições graves tivessem uma chance de sobreviver até a realização de cirurgias corretivas. Além disso, é um exemplo marcante de como a medicina intervencionista pode salvar vidas com técnicas menos invasivas, rápidas e altamente eficazes, reduzindo riscos e melhorando a qualidade de vida desses pequenos pacientes.
Links de referência:
https://www.msdmanuals.com/pt/casa/multimedia/image/septostomia-atrial-com-bal%C3%A3o-procedimento-de-rashkind
https://my.clevelandclinic.org/health/treatments/23042-septostomy.
Texto: Cibele Sperone – Coração & Perfusão




 Vejam alguns exemplos:
Vejam alguns exemplos: